Гарантии:1. Опыт >10 лет2. Множество положительных отзывов 3. Оплачивать можно частями 4. Исправления/доработки бесплатны |
Что можно заказать:1. Онлайн помощь на экзаменах2. Контрольные работы 3.Лабораторные работы 4. Курсовые работы 5. Диплом/Диссертацию |
Решение задач.
Решение задач по химии может быть письменным, устным, подробным, графическим, наглядным и еще 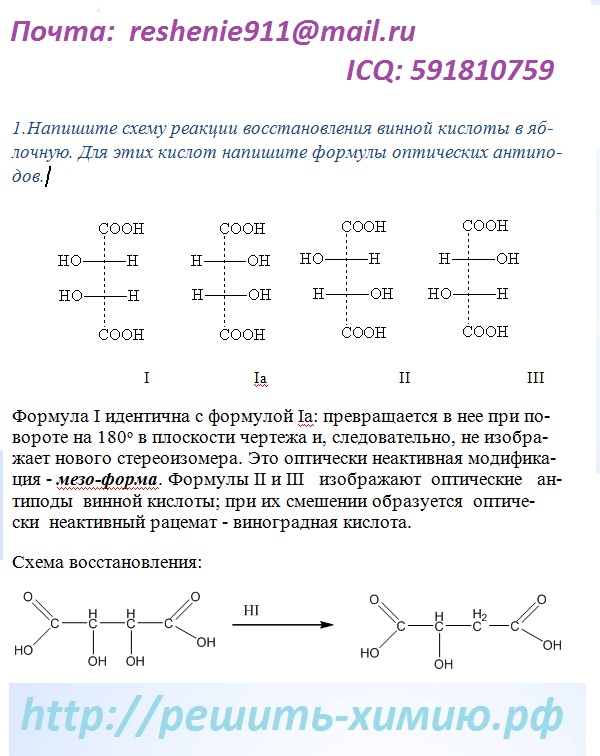 правильным! Каким бы оно ни было, самым важным является именно правильность решения. Обратим внимание на подходы к решению задач. Всех нас еще в школе учили тому, как нужно решать задачу и с чего нужно начинать. Решение задач по химии не является исключением и тут все так же как в математике, физике и даже биологии. Начинать нужно с переписывания условия задачи. Это нужно чтоб преподаватель, при проверке, смог увидеть, что нужно было найти, каким методом, по каким пунктам, в каком виде записать и как подать решение. После записи условия нужно составить «Дано», это, по сути, тоже условие, только в более кратком и технически грамотном виде. «Дано» всегда лаконично, в нем записываются все данные условии задачи величины: массы веществ, типы реакций, температура, время, цвет, и многое другое. Ниже «Дано» всегда подводится черта, и записываются все величины, которые требуется найти, а так же вопросы по заданию. Каждый абзац будем сопровождать несколькими примерами решений задач по химии:
правильным! Каким бы оно ни было, самым важным является именно правильность решения. Обратим внимание на подходы к решению задач. Всех нас еще в школе учили тому, как нужно решать задачу и с чего нужно начинать. Решение задач по химии не является исключением и тут все так же как в математике, физике и даже биологии. Начинать нужно с переписывания условия задачи. Это нужно чтоб преподаватель, при проверке, смог увидеть, что нужно было найти, каким методом, по каким пунктам, в каком виде записать и как подать решение. После записи условия нужно составить «Дано», это, по сути, тоже условие, только в более кратком и технически грамотном виде. «Дано» всегда лаконично, в нем записываются все данные условии задачи величины: массы веществ, типы реакций, температура, время, цвет, и многое другое. Ниже «Дано» всегда подводится черта, и записываются все величины, которые требуется найти, а так же вопросы по заданию. Каждый абзац будем сопровождать несколькими примерами решений задач по химии:
1. Напишите молекулярные и ионные уравнения реакций, при помощи которых можно осуществить следующие превращения: оксид железа (II) - > хлорид железа (II) - > гидроксид железа (II) - > оксид железа (II) - > железо - > сульфат железа (II).
FeO→FeCI2→Fe(OH)2→FeO →Fe→FeSO4
Молекулярные уравнения
1)FeO+2HCI = FeCI2+H2O
2)FeCI2+2NaOH = Fe(OH)2+2NaCI
3)Fe(OH)2→ FeO + H2O (прокаливание при t=150-200°C)
4)FeO+H2→Fe+H2O
5)Fe+H2SO4 (разбавленная)→ FeSO4 + H2
Ионные уравнения
1)FeO+2H+ = Fe+2+H2O
2) Fe+2+2OH- = Fe(OH)2
3)Fe(OH)2→ FeO + H2O (прокаливание при t=150-200°C)
4)FeO+H2→Fe+H2O
5)Fe0+2H+ (разбавленная)→ Fe2+ + H2
*для 3 и 4 реакции ионное уравнение написать нельзя так как эти реакции протекают не в водном растворе (вещества не диссоциируют)
Все, следующим этапом является решение задачи. Перед тем как начать непосредственно решать – нужно ознакомиться с материалом на тематику рассматриваемой задачи, в уме составить приблизительный алгоритм решения, найти формулы, если нужно графики, взять таблицу Менделеева и переходить к следующему этапу – это уже непосредственно решение. Этот этап опирается на предыдущий, т.е. по придуманному алгоритму записываются формулы, подставляются величины в них, производятся вычисления и записывается ответ. Подошел к концу абзац, ниже решение задачи по химии. Напомним, что если у Вас нет времени решать самостоятельно – то Вы всегда можете заказать решение задач по химии у нас.
2. Дайте характеристику свойств и электронного строения элемента № 38 исходя из положения в периодической системе элементов Д.И.Менделеева.
Решение:
Электронное строение Стронция [Kr] 5s2
Данный элемент находится во второй группе периодической системы Д.И. Менделеева. На внешнем электронном уровне( s-уровне) имеет 2 электрона
Стронций в своих соединениях всегда проявляет валентность 2 и степень окисления +2. По свойствам стронций близок к кальцию и барию, занимая промежуточное положение между ними.
В электрохимическом ряду напряжений стронций находится среди наиболее активных металлов (его нормальный электродный потенциал равен −2,89 В). Энергично реагирует с водой, образуя гидроксид:
Sr + 2H2O = Sr(OH)2 + H2↑
Взаимодействует с кислотами, вытесняет тяжёлые металлы из их солей.
Металлический стронций быстро окисляется на воздухе, образуя желтоватую плёнку, в которой помимо оксида SrO всегда присутствуют пероксид SrO2. При нагревании на воздухе загорается, порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами. Таким образом Стронций проявляет ярко выраженные металлические свойства, что соответствует его положению в периодической системе.
Если в заданной задаче требуется построить график (а это очень часто нужно при решении физической химии) – то, выражается зависимость в аналитическом виде, составляется таблица из двух столбцов и записываются данные точек, по которым нужно построить график. Данные точек получают путем подстановки в формулу функции переменной величины с некоторым шагом, на что получают соответствующие значения зависимой величины. Полученные значения вносят в таблицу. После этого, по точкам, на координатной плоскости строят график требуемой зависимости, т.е. проставляют точки и соединяют их плавной кривой, все график к задаче готов.
Как же применить написанное выше к решению задач по химии? Тут все просто – приведем пример задач и решение, это самый наглядный способ обучения. Приведенные ниже задачи с решениями настолько короткие, что в них нет необходимости составлять «Дано», в этом случае пишется условие и сразу решение. Это последний абзац данной статьи и соответсвенно последнее решение задачи по химии:
3. Сплав меди с алюминием массой
нового остатка. Какой состав исходного сплава?
Со щелочью реагирует только один компонент сплава - алюминий. Запишем уравнение реакции
2Al+2NaOH+ 6H2O→2Na [Al(OH)4]+3H2
Остаток (медь) взаимодействует с разбавленной азотной кислотой с выделением оксида азота (II)
3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
После выпаривания остается нитрат меди (Cu(NO3)2). При прокаливании полученной соли получается оксид меди (II) данное вещество и будет полученным новым остатком
2Cu(NO3)2→2CuO+4NO2+O2
m(CuO)=0.4 грамм
Находим количество моль CuO
=0,005 моль
Согласно уравнениям химических реакций приведенным выше, количество моль CuO равно количеству моль Cu:
Находим массу меди:
m(Cu)=
=0,005*64=0,32 грамм
Находим массу алюминия в исходном сплаве, как разницу между массой сплава и массой меди которая входит в его состав:
m(Cu)= m(сплава)-m(Cu)=1-0,32=0,68 грамм
Находим массовые доли компонентов в сплаве:
W(Cu)=0.32/1=0.32 или 32,0 %
W(Al)=0.68/1=0.68 или 68,0 %
Ответ: сплав состоит из 32,0% меди и 68 % алюминия
4. Составьте уравнения реакций гидролиза следующих солей в молекулярном и ионном виде: Al2(SO4)3, К2S.
а) Al2(SO4)3-соль образованная слабым основанием и сильной кислотой. Гидролиз будет происходить по основанию.
Молекулярные уравнения гидролиза
Al2(SO4)3+ 2H2O = 2(AlOH)SO4+ H2SO4 (1-вая степень гидролиза)
2(AlOH)SO4+ 2H2O = 2(Al(OH)2)2SO4+ H2SO4 (2-я степень гидролиза)
2(Al(OH)2)2SO4+ 2H2O =2Al(OH)3+ H2SO4 (3-я степень гидролиза)
Ионные уравнения гидролиза
2Al3++ 2H2O = 2(AlOH)2-+2H+ (1-вая степень гидролиза)
2(AlOH)2- + 2H2O = 2(AlOH)2 -+2H+ (2-я степень гидролиза)
2(AlOH)2 + 2H2O =2Al(OH)3+2H+ (3-я степень гидролиза)
б) К2S -соль образованная сильным основанием и слабой кислотой. Гидролиз будет происходить по кислотному остатку.
Молекулярные уравнения гидролиза
К2S+ H2O= KHS+KOH (1-вая степень гидролиза)
KHS+ H2O=H2S+ KOH (2-я степень гидролиза)
Ионные уравнения гидролиза
S2-+ H2O= HS-+OH- (1-вая степень гидролиза)
HS-+H2O=H2S+ OH- (2-я степень гидролиза)
